26.12.2019

Возникает больше свидетельств того, что зараза и хроническое неактивное воспаление в периферических тканях являются необходимыми патогенными факторами при тяжёлом депрессивном расстройстве. Большая депрессия нередко смешивается с системными воспалительными болезнями, таковыми как ревматоидный артрит, аллергии разных типов, растерянный склероз, сердечно-сосудистые заболевания, воспалительные заболевания кишечного тракта, приобретенные заболевания печени, диабет и рак, при которых провоспалительные цитокины сверхэкспрессируются. Ряд исследовательских работ на звериных указывает, что системное воспаление, вызванное периферическим введением липополисахарида, наращивает экспрессию провоспалительных цитокинов как на периферии, так и в мозге, и вызывает аномальное поведение, схожее большенному депрессивному эпизоду.
Системное воспаление может вызывать увеличение уровней провоспалительных цитокинов в ЦНС, связанных с глиальной активацией, а конкретно нейровоспалением, через несколько постулируемых путей. Такое нейровоспаление может, в свою очередь, вызывать депрессивное настроение и поведенческие конфигурации, затрагивая функции мозга, связанные с большенный депрессией, в особенности метаболизм нейротрансмиттеров. Хотя разные клинические исследования подразумевают наличие причинно-следственной связи меж периодонтитом, который является одним из более всераспространенных приобретенных воспалительных болезней у взрослых, и большенный депрессией, понятие о том, что периодонтит является фактором риска тяжеленной депрессии, до сего времени не подтверждено. Для обоснования причинно-следственной связи периодонтита с большенный депрессией нужны доп популяционные когортные исследования либо проспективные клинические исследования связи меж периодонтитом и большенный депрессией. Если таковая связь установлена, периодонтит быть может изменяемым фактором риска развития тяжеленной депрессии при помощи обычного профилактического орального исцеления.
Введение
Было отлично задокументировано, что воспаление тесновато соединено с большенный депрессией, хотя остается неясным, является ли воспаление предпосылкой либо следствием психологического заболевания. Связь меж воспалением и тяжёлой депрессией подтверждается отлично известными клиническими наблюдениями о том, что провоспалительные цитокины, такие как интерферон (IFN) -α, который употребляется для исцеления гепатита С, рака почки и множественной миеломы, также интерлейкина (IL)) -2, который употребляется для исцеления рака почки и ангиосаркомы, нередко вызывает симптомы депрессии в качестве побочных эффектов (Hashioka et al., 2009). Наиболее 50% пациентов, получавших высочайшие дозы IFN-α, соответствовали диагностическим аспектам для большенный депрессии в течение 3 месяцев опосля введения IFN-α (Musselman et al., 2001). Не считая того, на физическом уровне нездоровые пациенты с приобретенным воспалением нередко проявляют симптомы большенный депрессии (Dantzer, 2017). Эти клинические наблюдения параллельных результатов наблюдаются в ряде исследовательских работ на звериных. Было показано, что периферическое введение липотисахарида эндотоксина (LPS), компонента грамотрицательной бактериальной клеточной стены, мышам наращивает экспрессию провоспалительных цитокинов, таковых как IL-1β, IL-6 и фактор некроза опухоли (TNF). -α, как на периферии, так и в мозге, в особенности в микроглии и периваскулярных макрофагах мозга (Layé et al., 1994 ; Godbout et al., 2008), и вызывают аномальное поведение, схожее большенный депрессии (O’Connor et al. , 2009 ; Biesmans et al., 2013). Также было продемонстрировано, что системное введение провоспалительных цитокинов вызывает депрессивное поведение у грызунов (Anforth et al., 1998 ; Kaster et al., 2012).
Большая депрессия, по-видимому, является гетерогенной заболеванием с разными генетическими и экологическими факторами, содействующими развитию заболевания (Shelton, 2007). Системная зараза и воспалительные процессы могут также играться роль в патогенезе большенный депрессии, по последней мере, в подгруппе восприимчивых людей. Целью данной статьи является обзор вероятной роли системного воспаления в патогенезе большенный депрессии и вероятной причинной связи периодонтита, который является одним из более всераспространенных воспалительных болезней у взрослых, с клиническим началом и развитием большенный депрессии.
Системное воспаление и депрессия
Большая депрессия нередко смешивается с системными воспалительными болезнями / состояниями, таковыми как ревматоидный артрит, аллергии разных типов, растерянный склероз, сердечно-сосудистые заболевания, воспалительные заболевания кишечного тракта, приобретенные заболевания печени, диабет и рак, при которых провоспалительные цитокины сверхэкспрессируются (Эванс et al., 2005 ; Leonard, 2007 ; D’Mello и Swain, 2017). К примеру, у пациентов с большенный депрессией возможность развития сердечных болезней в два раза выше, если учесть последствия курения и гипертонии (Anda et al., 1993). Как следует, неизменное слабенькое воспаление в периферических тканях быть может всераспространенным механизмом, лежащим в базе высочайшей сопутствующей патологии меж большенный депрессией и физическим болезнью.
Появляющиеся данные указывают на то, что системное воспаление оказывает глубочайшее воздействие на поведение. Отлично понятно, что системное воспаление вызывает синтез провоспалительных цитокинов, которые связываются с мозгом, вызывая диапазон поведенческих конфигураций, узнаваемых как болезненное поведение (Perry, 2004). Болезненное поведение содержит в себе определенные признаки, схожие с клинически важными симптомами большенный депрессии, таковыми как утрата аппетита, нарушение сна, понижение активности и понижение общественного энтузиазма. Тем не наименее, некие нейробиологи считают, что болезненное поведение является быстрее адаптивным ответом на заразу патогенными микробами и на сто процентов обратимым, когда патоген очищается; это не относится к большенный депрессии (Dantzer et al., 2008). Они сделали мышиную модель депрессии, вызванной воспалением, используя системное введение LPS, и говорят, что депрессивно-подобное поведение, вызванное LPS, реально отличить от поведения, связанного с заболеванием, на звериной модели (Dantzer et al., 2008 ; O’Connor et al. ., 2009). А именно, болезненное поведение, измеряемое понижением употребления еды, понижением соц исследовательских работ и понижением двигательной активности, развивается в течение нескольких часов опосля инъекции LPS и миниатюризируется на 12–16 ч опосля LPS. Потом депрессивно-подобное поведение возникает через 24 ч опосля инъекции LPS, о чем свидетельствует увеличенное время неподвижности в тесте принудительного плавания (FST), тесте подвески хвоста (TST) и сниженном предпочтении сахарозы. Эти создатели также настаивают на том, что эта диссоциация меж болезненным поведением и депрессивно-подобным поведением в ответ на LPS согласуется со временем развития симптомов депрессии в ответ на IFN-α у пациентов с раком (Dantzer et al., 2008 ; Данцер, 2017). В этот период времени нейровегетативные симптомы, включая понижение аппетита, нарушения сна и вялость, возникают первыми в ответ на повторные инъекции IFN-α, тогда как симптомы настроения и когнитивные симптомы возникают позднее (Capuron et al., 2002). Экспериментальный вывод о том, что у мышей схожее депрессивное поведение находится без осложняющих последствий болезненного поведения через 24 ч опосля системного введения ЛПС, является, но, спорным. Чжу и соавт. (2010) проявили, что депрессивно-подобное поведение возникает даже в наиболее ранешние моменты времени (к примеру, через 10 минут – через несколько часов опосля введения ЛПС), а остальные проявили, что мыши, получающие высшую дозу ЛПС, все еще проявляют выраженное болезненное поведение через 24 часа опосля ЛПС инъекция (Berg et al., 2004 ; Godbout et al., 2008 ; Biesmans et al., 2013). Это несоответствие быть может соединено с различием в возрасте применяемых мышей, дозе LPS, серотипе LPS, пути внедрения и применяемых анализах. Было продемонстрировано, что селективный ингибитор оборотного захвата серотонина и ингибитор оборотного захвата серотонина и норэпинефрина ослабляют LPS-индуцированное депрессивно-подобное поведение и LPS-индуцированное увеличение сывороточных уровней провоспалительных цитокинов у мышей (Ohgi et al., 2013).
Упомянутые выше исследования на звериных употребляли однократное системное введение LPS, которое может вызывать острую и сильную, но эфемерную активацию периферической иммунной системы. Но сплетенная с воспалением депрессия у человека быстрее связана с приобретенным воспалением (Leonard, 2018). Не так давно было проведено несколько исследовательских работ на звериных, целью которых было создание симпатичных трансляционных моделей депрессии, связанной с воспалением, у людей. Кубера и соавт. (2013) сделали модель мыши, в какой повторное и прерывающееся введение ЛПС в течение 4 месяцев вызывает хроническое состояние ангедонии, что показывает на то, что хроническое введение ЛПС быть может наиболее пригодным подходом для индуцирования депрессивного поведения. Моро и соавт. (2005 , 2008) проявили, что инокуляция Bacillus Calmette-Guerin (BCG), аттенуированной формы Mycobacterium bovis , мышам вызывает долгое увеличение уровней провоспалительного цитокина IFN-α в сыворотке в течение 26 дней и изначальное За эпизодом болезненного поведения, который развивается через некоторое количество дней опосля инокуляции БЦЖ, следует долгое понижение предпочтения сахарозы и повышение неподвижности в FST и TST.
Как системное воспаление влияет на настроение и поведение?
Как периферия ведет взаимодействие с мозгом, модулирует нейротрансмиссию и, как следует, меняет поведение, не совершенно ясно. Тем не наименее, несколько путей коммуникации меж системной иммунной системой и мозгом были постулированы (Perry, 2004 ; Capuron and Miller, 2011 ; D’Mello and Swain, 2017). Системный воспалительный ответ приводит к секреции провоспалительных цитокинов, включая IL-1β, IL-6 и TNF-α, из активированных макрофагов и моноцитов. Провоспалительные цитокины циркулируют в крови и связываются с нейронами и микроглией в мозге через пути коммуникации, упомянутые ниже. Хоть какой из этих путей может в итоге привести к повышению уровня провоспалительных цитокинов в головном мозгу и активации микроглии (в предстоящем в данной нам статье «нейровоспаление»). 1-ый путь – это нервный путь, по которому системные цитокины конкретно активируют первичные афферентные нервишки, такие как блуждающий нерв. Сигнал добивается первичной и вторичной проекции нервного пути, достигающего поначалу солитарного ядра тракта, а потом разных ядер гипоталамуса (Capuron and Miller, 2011). Было показано, что субдиафрагмальная ваготомия перекрывает вызванное ЛПС болезненное поведение у крыс (Bluthé et al., 1994), в то время как оно не влияет на индуцированный ЛПС синтез провоспалительных цитокинов на периферии. 2-ой путь – это гуморальный путь, включающий в себя сосудистое сплетение и органы вентрикулярного отдела, в каких отсутствует интактный гематоэнцефалический барьер (ГЭБ). Эти протекающие области могут быть точками доступа циркулирующих провоспалительных цитокинов для проникания в паренхиму мозга методом большой диффузии и выявления событий передачи сигналов вниз по течению, принципиальных для конфигурации функции мозга (D’Mello and Swain, 2017). 3-ий маршрут – это клеточный путь. Системное воспаление соединено с активацией церебральных эндотелиальных клеток (ЦИК), также с повышением циркулирующих моноцитов (D’Mello and Swain, 2017). Системные провоспалительные цитокины активируют CECs, экспрессирующие сенсоры TNF-α и IL-1β, которые, в свою очередь, говорят периваскулярным макрофагу, размещенным в конкретной близости от CECs (Perry, 2004). Эти периваскулярные макрофаги потом связываются с микроглией и, таковым образом, приводят к активации микроглии. Активированная микроглия секретирует не только лишь провоспалительные цитокины, но также протеазы и хемокины, включая моноцитарный хемоаттрактантный белок (МСР) -1. Предполагается, что МСР-1 несет ответственность за рекрутирование моноцитов в области моторной коры, гиппокампа и базальных ганглиев, области мозга, которые, как понятно, участвуют в контроле поведения (D’Mello et al., 2009).
Как провоспалительные сигналы цитокинов добиваются мозга с периферии, они могут повлиять на некие патофизиологические домены, функции и нейротрансмиссию, относящиеся к большенный депрессии, такие как передняя поясная извилина (беспокойство и возбуждение), базальные ганглии (мотивация и двигательная активность), нейроэндокринная функция (резистентность к глюкокортикоидам и модифицированная секреция глюкокортикоидов), синаптическая пластичность (нарушенный нейрогенез) и метаболизм нейротрансмиттеров (Capuron and Miller, 2011). Микроглия, активируемая системным цитокином, говорит о скрытых провоспалительных цитокинах, которые активируют индоламин-2,3-диоксигеназу (IDO), 1-ый и ограничивающий скорость фермент пути кинуренина. IDO катализирует синтез кинуренина из диетического триптофана. Это может содействовать развитию депрессивных симптомов за счет понижения доступности триптофана, нужного для синтеза серотонина и мелатонина.
Активация микроглии была связана с депрессивным поведением. Ряд исследовательских работ на звериных показал, что мыши, чья микроглия активизируется системной инъекцией LPS, проявляют тошноту и депрессивное поведение (Biesmans et al., 2013 ; Townsend et al., 2014 ; Norden et al., 2016). Мы подтвердили, что крысы Ганна (мутантная порода крыс обнаруженная в 1934 г., с желтухой и генетическим недостатком глюкоуронилтрансферазы; прим. переводчика) с прирожденным микроглиозом и гипербилирубинемией показывали увеличенное время неподвижности как в FST, так и в TST, что показывает на то, что активация микроглии быть может связана с полученной беспомощностью (Arauchi et al., 2018). Не считая того, исследования на звериных проявили, что фармакологическое ингибирование активированной микроглии улучшает как поведение, связанное с заболеванием, так и депрессивное поведение. Введение миноциклина мышам снижало индуцированную ЛПС экспрессию микроглии провоспалительных цитокинов и облагораживало поведение при заболеваниях и ангедонии (Henry et al., 2008). Введение миноциклина на сто процентов ингибировало повышение и активацию микроглии в гиппокампе и уменьшало депрессивное поведение, схожее приобретенному легкому стрессу, в FST и тесте в открытом поле (Wang et al., 2018). Посмертные исследования также демонстрируют, что активированная микроглия вовлечена в мозг пациентов с большенный депрессией (Bayer et al., 1999 ; Steiner et al., 2011). Iwata et al.. (2016) не так давно проявили, что психический стресс наращивает количество внеклеточного аденозинтрифосфата (АТФ) в гиппокампе. Завышенная внеклеточная АТФ связывается с пуринергическим сенсором типа 2X7 (P2X7R) на микроглии и потом активирует нуклеотидсвязывающий лейцин-богатый повтор, содержащий пириновый домен (NLRP) 3 в микроглии, чтоб индуцировать высвобождение IL-1β в микроглии. Было показано, что IL-1β понижает нейрогенез в гиппокампе у взрослых, и этот эффект связан с развитием ангедонии (Koo and Duman, 2008). Соответственно, создатели говорят, что воспалительный каскад ATP / P2X7R-NLRP3 в микроглии быть может терапевтической мишенью для исцеления депрессии, связанной со стрессом.
Путь пищеварительной микробиологической флоры к мозгу получает все большее внимание из-за его возможности модулировать функции мозга. Недавнешнее исследование на звериных показало, что блокада периферического сенсора IL-6 антителом против мышиного сенсора IL-6 содействует резвому и устойчивому антидепрессантному эффекту методом полной нормализации модифицированного состава микробиологической флоры кишечного тракта у чувствительных мышей опосля стресса общественного поражения. Это показывает на то, что пищеварительная микробиологическая флора имеет связь меж мозгом и играет важную роль в активном антидепрессивном действии анти-IL-6-рецепторной терапии (Zhang et al., 2017).
Пародонтит и большая депрессия
Пародонтит является приобретенной оральной мультибактериальной заразой и одним из более всераспространенных воспалительных болезней у взрослых. В 2009–2010 гг. общая распространенность периодонтита у взрослых в возрасте 30 лет и старше в Соединенных Штатах составляла 47,2% (Eke et al., 2012). Глобальная организация здравоохранения сказала, что 10–15% населения мира мучаются от томного периодонтита (Petersen and Ogawa, 2005). Пародонтит быть может классифицирован как гингивит, когда воспаление локализуется в тканях десны, либо он может принимать наиболее суровую деструктивную форму, при всем этом воспалительный процесс добивается наиболее глубочайших соединительных и костных тканей, вызывая утрату кости и прикрепления, что в итоге может привести к зубу утрата. Пародонтит сам по для себя является приобретенным воспалением слабенькой степени, но он вызывает либо ускоряет остальные приобретенные системные воспалительные заболевания, включая склероз, сердечно-сосудистые заболевания, диабет и ревматоидный артрит (Holmstrup et al., 2017). Это показывает на то, что периодонтит является значимым источником системных воспалительных молекул. Кроме действия на системные воспалительные расстройства, крайние клинические исследования подразумевают, что периодонтит является фактором риска для такового нейровоспалительного и нейродегенеративного расстройства, как болезнь Альцгеймера (AD). Предварительное исследование показало поперечную связь меж завышенными уровнями серологического маркера Porphyromonas gingivalis (Pg), основного патогена пародонтита, и нарушенной задержкой памяти и вычислений у пациентов старше 60 лет, что дозволяет представить, что периодонтит связан с когнитивным нарушения в старом возрасте (Noble et al., 2009). Шестимесячное наблюдательное когортное исследование показало, что когнитивное состояние группы AD с периодонтитом в текущее время усугубляется по сопоставлению с таким в группе AD с отсутствием периодонтита в точке наблюдения (Ide et al., 2016). Не считая того, LPS от Pg был найден в мозге AD, но не в контрольном мозге (Poole et al., 2013).
Разные клинические исследования также подразумевают причинно-следственную связь меж периодонтитом и большенный депрессией (Klages et al., 2005 ; Rosania et al., 2009). Дистресс, который испытывают пациенты с периодонтитом, существенно коррелировал с прогрессированием периодонтита (Rai et al., 2011). Приобретенный стресс и депрессия могут опосредовать риск и прогрессирование пародонтита средством конфигурации поведения, связанного со здоровьем, такового как гигиена полости рта, курение и диета (Warren et al., 2014). Не считая того, так как периодонтит стал приобретенным, появление депрессии возросло (Tang and Cao, 2011). Популяционное когортное исследование в течение долгого (10 лет) периода наблюдения показало наиболее высшую частоту следующей депрессии в группе с периодонтитом (N = 12708), чем в группе без периодонтита (N = 50832) со скорректированной коэффициент риска 1,73 с учетом пола, возраста и сопутствующей патологии (Hsu et al., 2015 . Этот итог свидетельствует о том, что периодонтит является независящим фактором риска развития тяжеленной депрессии независимо от пола, возраста и сопутствующих болезней, кроме диабета, злоупотребления алкоголем и рака. Любопытно, что исследование на звериных показало, что тианептин, трициклические антидепрессанты, которые, как было показано, владеют антивосполительными качествами (Hashioka et al., 2007 , 2009), понижают тяжесть периодонтита и облагораживают поведение, связанное с чувственностью и тревожностью, при обонятельной бульбэктомии модель депрессии у крыс с лигатурным периодонтитом (Breivik et al., 2006). Клиническое исследование в поперечном разрезе также показало, что прием флуоксетина, другого типа антидепрессантов (т.е. селективного ингибитора оборотного захвата серотонина), связан с наиболее низким риском развития кровотечений при процентном исследовании и наименьшей потерей привязанности у пациентов с приобретенным периодонтитом и медицинской депрессией (Bhatia et al. ., 2015).
Вероятная связь меж периодонтитом и развитием большенный депрессии
Предполагается, что как психосоциальные, так и био механизмы связывают периодонтит и развитие глубочайшей депрессии. Пародонтит может прирастить риск депрессии из-за психосоциальных эффектов дурного аромата изо рта, таковых как стыд, одиночество, смущение и дискомфорт (Dumitrescu, 2016). Не считая того, беззубость, вызванная периодонтитом из-за воспалительного разрушения тканей, поддерживающих зубы (т.е. периодонтальной связки и альвеолярного отростка), может воздействовать на свойство жизни пациента. Беззубость усугубляет не только лишь жевание, да и образ тела, самооценку и соц статус (Saintrain and de Souza, 2012).
Предполагается, что био механизмы, при помощи которых периодонтит вызывает огромную депрессию, состоят из 2-ух способностей: (1) нейровоспаление (другими словами увеличение уровня провоспалительных цитокинов в ЦНС, связанное с глиальной активацией), вызванное системным воспалением, связанным с периодонтитом; (2) нейровоспаление, вызванное прямой инвазией пародонтального патогена и его воспалительных товаров в мозг. В пародонтальном кармашке бактерии есть в мультислойной зубной биопленке, которая состоит из микробов и их компонент (к примеру, эндотоксин LPS и причины вирулентности; Socransky and Haffajee, 2002). Как следует, воспаленный пародонтальный кармашек быть может значимым источником медиаторов воспаления и патогенов. По микробиологическому окрасу большая часть микробов являются грамположительными аэробами. При пародонтите примерно 85% микробов являются грамотрицательными, при этом три главных бактерии пародонта именуются «красноватым комплексом», а конкретно Tannerella forsythia, и Treponema denticola и Porphyromonas gingivalis (Kamer et al., 2008 ; суммировано в таблице 1). Так как эти бактерии способны просачиваться в неповрежденный карманный эпителий, бактерии пародонта и их продукты могут получить доступ к кровообращению (Kamer et al., 2008). Это приводит к бактериемии и системному распространению бактериальных товаров. По сути Gomes et al. (2018) не так давно сказали, что субъекты с приобретенным периодонтитом и депрессией показывают существенно завышенные уровни LPS в корневых каналах по сопоставлению с субъектами с приобретенным периодонтитом без депрессии и обычного контроля. Это исследование также указывает сильную положительную связь меж приобретенным периодонтитом либо уровнем ЛПС корневого канала и тяжестью депрессии, измеренной с внедрением шкалы оценки депрессии Гамильтона и инвентаризации депрессии Бека. Как следует, предполагается, что завышенные уровни LPS связывают периодонтит с следующей депрессией, таковой как периферическая инъекция LPS, которая вызывает депрессивное поведение у мышей. Так как пародонтальный патоген и его продукты, в особенности LPS, могут индуцировать провоспалительные цитокины, такие как Il-1β, IL-6 и TNF-α (Liu et al., 2017 ; Wu et al., 2017), эти цитокины могут также войти в системный круговорот. Систематическое распространение микробов, их ЛПС и медиаторов воспаления, вызванных периодонтитом, инициирует системное воспаление либо ухудшение состояния, если другое системное воспаление уже существует. Системное воспаление, вызванное периодонтитом, может воздействовать на поведение и настроение средством вероятных путей коммуникации меж периферией и мозгом, что приводит к нейровоспалению, как упомянуто выше.
Таблица 1
Спецификация
Причины вирулентности
Нейроаминидазы
Связанные заболевания
Porphyromonas gingivalis
Липополисахарид SerB протеин
Gingipains (семейство протеаз, секретируемых Porphyromonas gingivalis, который был исследован на предмет его роли в развитии заболевания Альцгеймера; прим. переводчика)
Гемоагглютинин фимбрий
PG0352
Ревматоидный артрит
Бактериальный кольпит
Tannerella forsythia
BspA-гемоагглютинин
NanH (TF0035) SiaH
Склероз, Бактериальный кольпит
Treponema denticola
CfpA
TDE0471
Бактериальный кольпит
Системная инъекция LPS, как было продемонстрировано, расщепляет BBB средством аномальной активации матричной металлопротеиназы (Bohatschek et al., 2001 ; Frister et al., 2014). Как следует, также может быть, что патоген и его воспалительные продукты могут просачиваться в мозг и конкретно вызывать нейровоспаление опосля системного распространения LPS, вызванного пародонтитом, происходящего из «красноватого комплекса», в некой степени разрушающего BBB. На теоретическом уровне, такое нейровоспаление, спровоцированное прямой инвазией микробов пародонта и их воспалительных товаров, может также вызывать депрессивное настроение и поведенческие конфигурации, хотя не было никакого посмертного исследования, которое бы показало наличие LPS из «красноватого комплекса» в мозге субъектов с большая депрессия
Заключение
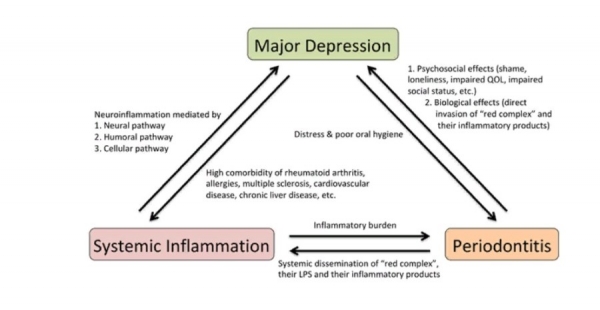
Предполагаемые механизмы оборотной связи меж системным воспалением, периодонтитом и большенный депрессией суммированы на рисунке 1 . Возникает больше свидетельств того, что зараза и неизменное слабенькое воспаление в периферических тканях являются необходимыми патогенными факторами, которые разъясняют вероятный патофизиологический механизм большенный депрессии. Системное воспаление может вызвать депрессивное настроение и поведенческие конфигурации, провоцируя нейровоспаление. Хотя разные клинические исследования подразумевают причинно-следственную связь меж периодонтитом и большенный депрессией, предположение о том, что периодонтит является фактором риска тяжеленной депрессии, все еще остается предположением. Доп популяционные когортные исследования либо проспективные клинические исследования связи меж периодонтитом и большенный депрессией оправдывают необходимость обоснования причинной связи периодонтита с большенный депрессией. Если таковая связь установлена, периодонтит быть может изменяемым фактором риска развития тяжеленной депрессии при помощи обычных профилактических мер гигиены полости рта.
Пару слов от переводчика для русских психиатров.
Создатель перевода: Белинский А.
Исчтоники:
Оригинальная статья
Anda, R., Williamson, D., Jones, D., Macera, C., Eaker, E., Glassman, A., et al. (1993). Depressed affect, hopelessness, and the risk of ischemic heart disease in a cohort of U.S. adults. Epidemiology 4, 285–294. doi: 10.1097/00001648-199307000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Anforth, H. R., Bluthe, R. M., Bristow, A., Hopkins, S., Lenczowski, M. J., Luheshi, G., et al. (1998). Biological activity and brain actions of recombinant rat interleukin-1alpha and interleukin-1beta. Eur. Cytokine Netw. 9, 279–288.
PubMed Abstract | Google Scholar
Arauchi, R., Hashioka, S., Tsuchie, K., Miyaoka, T., Tsumori, T., Limoa, E., et al. (2018). Gunn rats with glial activation in the hippocampus show prolonged immobility time in the forced swimming test and tail suspension test. Brain Behav. doi: 10.1002/brb3.1028 [Epub ahead of print].
PubMed Abstract | CrossRef Full Text | Google Scholar
Bayer, T. A., Buslei, R., Havas, L., and Falkai, P. (1999). Evidence for activation of microglia in patients with psychiatric illnesses. Neurosci. Lett. 271, 126–128. doi: 10.1016/S0304-3940(99)00545-5
CrossRef Full Text | Google Scholar
Berg, B. M., Godbout, J. P., Kelley, K. W., and Johnson, R. W. (2004). α-Tocopherol attenuates lipopolysaccharide-induced sickness behavior in mice. Brain Behav. Immun. 18, 149–157. doi: 10.1016/s0889-1591(03)00113-2
CrossRef Full Text | Google Scholar
Bhatia, A., Sharma, R. K., Tewari, S., Khurana, H., and Narula, S. C. (2015). Effect of fluoxetine on periodontal status in patients with depression: a cross-sectional observational study. J. Periodontol. 86, 927–935. doi: 10.1902/jop.2015.140706
PubMed Abstract | CrossRef Full Text | Google Scholar
Biesmans, S., Meert, T. F., Bouwknecht, J. A., Acton, P. D., Davoodi, N., De Haes, P., et al. (2013). Systemic immune activation leads to neuroinflammation and sickness behavior in mice. Mediators Inflamm. 2013:271359. doi: 10.1155/2013/271359
PubMed Abstract | CrossRef Full Text | Google Scholar
Bluthé, R. M., Walter, V., Parnet, P., Layé, S., Lestage, J., Verrier, D., et al. (1994). Lipopolysaccharide induces sickness behaviour in rats by a vagal mediated mechanism. C. R. Acad. Sci. III 317:499.
Google Scholar
Bohatschek, M., Werner, A., and Raivich, G. (2001). Systemic LPS injection leads to granulocyte influx into normal and injured brain: effects of ICAM-1 deficiency. Exp. Neurol. 172, 137–152. doi: 10.1006/exnr.2001.7764
PubMed Abstract | CrossRef Full Text | Google Scholar
Breivik, T., Gundersen, Y., Myhrer, T., Fonnum, F., Osmundsen, H., Murison, R., et al. (2006). Enhanced susceptibility to periodontitis in an animal model of depression: reversed by chronic treatment with the anti-depressant tianeptine. J. Clin. Periodontol. 33, 469–477. doi: 10.1111/j.1600-051X.2006.00935.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Capuron, L., Gumnick, J. F., Musselman, D. L., Lawson, D. H., Reemsnyder, A., Nemeroff, C. B., et al. (2002). Neurobehavioral effects of interferon-alpha in cancer patients: phenomenology and paroxetine responsiveness of symptom dimensions. Neuropsychopharmacology 26, 643–652. doi: 10.1016/s0893-133x(01)00407-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Capuron, L., and Miller, A. H. (2011). Immune system to brain signaling: neuropsychopharmacological implications. Pharmacol. Ther. 130, 226–238. doi: 10.1016/j.pharmthera.2011.01.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Dantzer, R. (2017). Role of the kynurenine metabolism pathway in inflammation-induced depression: preclinical approaches. Curr. Top. Behav. Neurosci. 31, 117–138. doi: 10.1007/7854-2016-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Dantzer, R., O’Connor, J. C., Freund, G. G., Johnson, R. W., and Kelley, K. W. (2008). From inflammation to sickness and depression: when the immune system subjugates the brain. Nat. Rev. Neurosci. 9, 46–56. doi: 10.1038/nrn2297
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Mello, C., Le, T., and Swain, M. G. (2009). Cerebral microglia recruit monocytes into the brain in response to tumor necrosis factoralpha signaling during peripheral organ inflammation. J. Neurosci. 29, 2089–2102. doi: 10.1523/JNEUROSCI.3567-08.2009
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Mello, C., and Swain, M. G. (2017). Immune-to-brain communication pathways in inflammation-associated sickness and depression. Curr. Top. Behav. Neurosci. 31, 73–94. doi: 10.1007/7854-2016-37
PubMed Abstract | CrossRef Full Text | Google Scholar
Dumitrescu, A. L. (2016). Depression and inflammatory periodontal disease considerations-an interdisciplinary approach. Front. Psychol. 7:347. doi: 10.3389/fpsyg.2016.00347
PubMed Abstract | CrossRef Full Text | Google Scholar
Eke, P. I., Dye, B. A., Wei, L., Thornton-Evans, G. O., Genco, R. J., CDC Periodontal Disease Surveillance workgroup: James Beck (University of North Carolina, Chapel Hill, USA) et al. (2012). Prevalence of periodontitis in adults in the United States: 2009 and 2010. J. Dent. Res. 91, 914–920. doi: 10.1177/0022034512457373
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, D. L., Charney, D. S., Lewis, L., Golden, R. N., Gorman, J. M., Krishnan, K. R., et al. (2005). Mood disorders in the medically ill: scientific review and recommendations. Biol. Psychiatry 58, 175–189. doi: 10.1016/j.biopsych.2005.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Frister, A., Schmidt, C., Schneble, N., Brodhun, M., Gonnert, F. A., Bauer, M., et al. (2014). Phosphoinositide 3-kinase gamma affects LPS-induced disturbance of blood-brain barrier via lipid kinase-independent control of cAMP in microglial cells. Neuromol. Med. 16, 704–713. doi: 10.1007/s12017-014-8320-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Godbout, J. P., Moreau, M., Lestage, J., Chen, J., Sparkman, N. L., O’Connor, J., et al. (2008). Aging exacerbates depressive-like behavior in mice in response to activation of the peripheral innate immune system. Neuropsychopharmacology 33, 2341–2351. doi: 10.1038/sj.npp.1301649
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomes, C., Martinho, F. C., Barbosa, D. S., Antunes, L. S., Povoa, H. C. C., Baltus, T. H. L., et al. (2018). Increased root canal endotoxin levels are associated with chronic apical periodontitis, increased oxidative and nitrosative stress, major depression, severity of depression, and a lowered quality of life. Mol. Neurobiol. 55, 2814–2827. doi: 10.1007/s12035-017-0545-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Hashioka, S., Klegeris, A., Monji, A., Kato, T., Sawada, M., McGeer, P. L., et al. (2007). Antidepressants inhibit interferon-gamma-induced microglial production of IL-6 and nitric oxide. Exp. Neurol. 206, 33–42. doi: 10.1016/j.expneurol.2007.03.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Hashioka, S., McGeer, P. L., Monji, A., and Kanba, S. (2009). Anti-inflammatory effects of antidepressants: possibilities for preventives against Alzheimer’s disease. Cent. Nerv. Syst. Agents Med. Chem. 9, 12–19. doi: 10.2174/187152409787601897
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, C. J., Huang, Y., Wynne, A., Hanke, M., Himler, J., Bailey, M. T., et al. (2008). Minocycline attenuates lipopolysaccharide (LPS)-induced neuroinflammation, sickness behavior, and anhedonia. J. Neuroinflammation 5:15. doi: 10.1186/1742-2094-5-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Holmstrup, P., Damgaard, C., Olsen, I., Klinge, B., Flyvbjerg, A., Nielsen, C. H., et al. (2017). Comorbidity of periodontal disease: two sides of the same coin? An introduction for the clinician. J. Oral Microbiol. 9:1332710. doi: 10.1080/20002297.2017.1332710
PubMed Abstract | CrossRef Full Text | Google Scholar
Hsu, C. C., Hsu, Y. C., Chen, H. J., Lin, C. C., Chang, K. H., Lee, C. Y., et al. (2015). Association of periodontitis and subsequent depression: a nationwide population-based study. Medicine 94:e2347. doi: 10.1097/MD.0000000000002347
PubMed Abstract | CrossRef Full Text | Google Scholar
Ide, M., Harris, M., Stevens, A., Sussams, R., Hopkins, V., Culliford, D., et al. (2016). Periodontitis and cognitive decline in Alzheimer’s disease. PLoS One 11:e0151081. doi: 10.1371/journal.pone.0151081
PubMed Abstract | CrossRef Full Text | Google Scholar
Iwata, M., Ota, K. T., Li, X. Y., Sakaue, F., Li, N., and Dutheil, S. (2016). Psychological stress activates the inflammasome via release of adenosine triphosphate and stimulation of the purinergic Type 2×7 receptor. Biol. Psychiatry 80, 12–22. doi: 10.1016/j.biopsych.2015.11.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Kamer, A. R., Craig, R. G., Dasanayake, A. P., Brys, M., Glodzik-Sobanska, L., and de Leon, M. J. (2008). Inflammation and Alzheimer’s disease: possible role of periodontal diseases. Alzheimers Dement. 4, 242–250. doi: 10.1016/j.jalz.2007.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kaster, M. P., Gadotti, V. M., Calixto, J. B., Santos, A. R., and Rodrigues, A. L. (2012). Depressive-like behavior induced by tumor necrosis factor-alpha in mice. Neuropharmacology 62, 419–426. doi: 10.1016/j.neuropharm.2011.08.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Klages, U., Weber, A. G., and Wehrbein, H. (2005). Approximal plaque and gingival sulcus bleeding in routine dental care patients: relations to life stress, somatization and depression. J. Clin. Periodontol. 32, 575–582. doi: 10.1111/j.1600-051X.2005.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Koo, J. W., and Duman, R. S. (2008). IL-1beta is an essential mediator of the antineurogenic and anhedonic effects of stress. Proc. Natl. Acad. Sci. U.S.A. 105, 751–756. doi: 10.1073/pnas.0708092105
PubMed Abstract | CrossRef Full Text | Google Scholar
Kubera, M., Curzytek, K., Duda, W., Leskiewicz, M., Basta-Kaim, A., Budziszewska, B., et al. (2013). A new animal model of (chronic) depression induced by repeated and intermittent lipopolysaccharide administration for 4 months. Brain Behav. Immun. 31, 96–104. doi: 10.1016/j.bbi.2013.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Layé, S., Parnet, P., Goujon, E., and Dantzer, R. (1994). Peripheral administration of lipopolysaccharide induces the expression of cytokine transcripts in the brain and pituitary of mice. Mol. Brain Res. 27, 157–162. doi: 10.1016/0169-328X(94)90197-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leonard, B. E. (2007). Inflammation, depression and dementia: are they connected? Neurochem. Res. 32, 1749–1756. doi: 10.1007/s11064-007-9385-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Leonard, B. E. (2018). Inflammation and depression: a causal or coincidental link to the pathophysiology? Acta Neuropsychiatr. 30, 1–16. doi: 10.1017/neu.2016.69
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y., Wu, Z., Nakanishi, Y., Ni, J., Hayashi, Y., Takayama, F., et al. (2017). Infection of microglia with Porphyromonas gingivalis promotes cell migration and an inflammatory response through the gingipain-mediated activation of protease-activated receptor-2 in mice. Sci. Rep. 7:11759. doi: 10.1038/s41598-017-12173-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreau, M., Andre, C., O’Connor, J. C., Dumich, S. A., Woods, J. A., Kelley, K. W., et al. (2008). Inoculation of Bacillus Calmette-Guerin to mice induces an acute episode of sickness behavior followed by chronic depressive-like behavior. Brain Behav. Immun. 22, 1087–1095. doi: 10.1016/j.bbi.2008.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreau, M., Lestage, J., Verrier, D., Mormède, C., Kelley, K. W., Dantzer, R., et al. (2005). Bacille Calmette-Guérin Inoculation induces chronic activation of peripheral and brain indoleamine 2,3-dioxygenase in mice. J. Infect. Dis. 192, 537–544. doi: 10.1086/431603
PubMed Abstract | CrossRef Full Text | Google Scholar
Musselman, D. L., Lawson, D. H., Gumnick, J. F., Manatunga, A. K., Penna, S., Goodkin, R. S., et al. (2001). Paroxetine for the prevention of depression induced by high-dose interferon alfa. N. Engl. J. Med. 344, 961–966. doi: 10.1056/nejm200103293441303
PubMed Abstract | CrossRef Full Text | Google Scholar
Noble, J. M., Borrell, L. N., Papapanou, P. N., Elkind, M. S., Scarmeas, N., and Wright, C. B. (2009). Periodontitis is associated with cognitive impairment among older adults: analysis of NHANES-III. J. Neurol. Neurosurg. Psychiatry 80, 1206–1211. doi: 10.1136/jnnp.2009.174029
PubMed Abstract | CrossRef Full Text | Гугл Scholar
Norden, D. M., Trojanowski, P. J., Villanueva, E., Navarro, E., and Godbout, J. P. (2016). Sequential activation of microglia and astrocyte cytokine expression precedes increased Iba-1 or GFAP immunoreactivity following systemic immune challenge. Glia 64, 300–316. doi: 10.1002/glia.22930
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Connor, J. C., Lawson, M. A., Andre, C., Moreau, M., Lestage, J., Castanon, N., et al. (2009). Lipopolysaccharide-induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice. Mol. Psychiatry 14,511–522. doi: 10.1038/sj.mp.4002148
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohgi, Y., Futamura, T., Kikuchi, T., and Hashimoto, K. (2013). Effects of antidepressants on alternations in serum cytokines and depressive-like behavior in mice after lipopolysaccharide administration. Pharmacol. Biochem. Behav. 103, 853–859. doi: 10.1016/j.pbb.2012.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, P. E., and Ogawa, H. (2005). Strengthening the prevention of periodontal disease: the WHO approach. J. Periodontol. 76, 2187–2193. doi: 10.1902/jop.2005.76.12.2187
PubMed Abstract | CrossRef Full Text | Google Scholar
Perry, V. H. (2004). The influence of systemic inflammation on inflammation in the brain: implications for chronic neurodegenerative disease. Brain Behav. Immun. 18, 407–413. doi: 10.1016/j.bbi.2004.01.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Poole, S., Singhrao, S. K., Kesavalu, L., Curtis, M. A., and Crean, S. (2013). Determining the presence of periodontopathic virulence factors in short-term postmortem Alzheimer’s disease brain tissue. J. Alzheimers Dis. 36, 665–677. doi: 10.3233/JAD-121918
PubMed Abstract | CrossRef Full Text | Google Scholar
Rai, B., Kaur, J., Anand, S. C., and Jacobs, R. (2011). Salivary stress markers, stress, and periodontitis: a pilot study. J. Periodontol. 82, 287–292. doi: 10.1902/jop.2010.100319
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosania, A. E., Low, K. G., McCormick, C. M., and Rosania, D. A. (2009). Stress, depression, cortisol, and periodontal disease. J. Periodontol. 80, 260–266. doi: 10.1902/jop.2009.080334
PubMed Abstract | CrossRef Full Text | Google Scholar
Saintrain, M. V., and de Souza, E. H. (2012). Impact of tooth loss on the quality of life. Gerodontology 29, e632–e636. doi: 10.1111/j.1741-2358.2011.00535.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Shelton, R. C. (2007). The molecular neurobiology of depression. Psychiatr. Clin. North Am. 30, 1–11. doi: 10.1016/j.psc.2006.12.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Socransky, S. S., and Haffajee, A. D. (2002). Dental biofilms: difficult therapeutic targets. Periodontol. 2000 28, 12–55. doi: 10.1034/j.1600-0757.2002.280102.x
CrossRef Full Text | Google Scholar
Steiner, J., Walter, M., Gos, T., Guillemin, G. J., Bernstein, H. G., Sarnyai, Z., et al. (2011). Severe depression is associated with increased microglial quinolinic acid in subregions of the anterior cingulate gyrus: evidence for an immune-modulated glutamatergic neurotransmission? J. Neuroinflammation 8:94. doi: 10.1186/1742-2094-8-94
PubMed Abstract | CrossRef Full Text | Google Scholar
Tang, Y.-H., and Cao, F.-Y. (2011). Investigation and analysis of depression occurrence in patients with chronic periodontitis. Shanghai Kou Qiang Yi Xue 20, 74–77.
PubMed Abstract | Google Scholar
Townsend, B. E., Chen, Y. J., Jeffery, E. H., and Johnson, R. W. (2014). Dietary broccoli mildly improves neuroinflammation in aged mice but does not reduce lipopolysaccharide-induced sickness behavior. Nutr. Res. 34, 990–999. doi: 10.1016/j.nutres.2014.10.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, Y. L., Han, Q. Q., Gong, W. Q., Pan, D. H., Wang, L. Z., Hu, W., et al. (2018). Microglial activation mediates chronic mild stress-induced depressive- and anxiety-like behavior in adult rats. J. Neuroinflammation 15:21. doi: 10.1186/s12974-018-1054-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Warren, K. R., Postolache, T. T., Groer, M. E., Pinjari, O., Kelly, D. L., and Reynolds, M. A. (2014). Role of chronic stress and depression in periodontal diseases. Periodontol. 2000 64, 127–138. doi: 10.1111/prd.12036
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, Z., Ni, J., Liu, Y., Teeling, J. L., Takayama, F., Collcutt, A., et al. (2017). Cathepsin B plays a critical role in inducing Alzheimer’s disease-like phenotypes following chronic systemic exposure to lipopolysaccharide from Porphyromonas gingivalis in mice. Brain Behav. Immun. 65, 350–361. doi: 10.1016/j.bbi.2017.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, J. C., Yao, W., Dong, C., Yang, C., Ren, Q., and Ma, M. (2017). Blockade of interleukin-6 receptor in the periphery promotes rapid and sustained antidepressant actions: a possible role of gut-microbiota-brain axis. Transl. Psychiatry 7:e1138. doi: 10.1038/tp.2017.112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, C. B., Lindler, K. M., Owens, A. W., Daws, L. C., Blakely, R. D., and Hewlett, W. A. (2010). Interleukin-1 receptor activation by systemic lipopolysaccharide induces behavioral despair linked to MAPK regulation of CNS serotonin transporters. Neuropsychopharmacology 35, 2510–2520. doi: 10.1038/npp.2010.116
PubMed Abstract | CrossRef Full Text | Google Scholar
Источник
Читайте далее: