Желание быть молодее практически вездесуще в нашем обществе. Если “моложавый” физический вид – одна из целей, то иная – возможность приостановить прогрессирующее угасание клеточных устройств, переносчиков болезней, будь то приобретенные, нейродегенеративные и т.д. Не считая того, население мира стареет. По данным Организации Объединенных Наций, к 2050 году любой 6-ой человек в мире будет старше 65 лет (16%) по сопоставлению с каждым одиннадцатым в 2019 году (9%). Не так давно исследователи разработали новейший способ, позволяющий направить назад старение человечьих клеток на 30 лет, что сделалось революцией в регенеративной медицине.
Старение – это непрерывный и прогрессивный процесс естественных конфигураций, который начинается в ранешном зрелом возрасте. Сначала среднего возраста почти все функции организма начинают равномерно понижаться. Таковым образом, с био точки зрения старение является результатом скопления широкого диапазона молекулярных и клеточных повреждений со временем. Это приводит к постепенному ухудшению физических и интеллектуальных возможностей, увеличению риска болезней и, в итоге, к погибели. Эти конфигурации не являются ни линейными, ни постоянными и не очень соединены с количеством лет. Но, хотя старение безизбежно, на него можно воздействовать.
Конкретно потому регенеративная медицина дает огромные надежды. Регенеративная медицина ориентирована на ремонт, подмену либо регенерацию отказавших генов, клеток либо органов для восстановления обычной функции. Потому она способна направить назад возрастные конфигурации. Исцеление содержит в себе пересадку восстанавливающих клеток в покоробленный участок пациента. Когда эти клеточки внедряются в орган-мишень (либо рядом с ним), они сами делают работу, восстанавливая здоровую ткань. Эти восстанавливающие клеточки именуются стволовыми. Проще говоря, это неспециализированные – недифференцированные – клеточки, способные к нескончаемому самообновлению и порождению, зависимо от среды, в которую они погружены, разных клеток, составляющих ткань.
Методика получения этих клеток представляет собой процесс преобразования соматических клеток в индуцированные плюрипотентные стволовые клеточки (iPSCs). Для этого нужно взять фактически всякую клеточку взрослого человека и на генном уровне перепрограммировать ее так, чтоб она стала плюрипотентной, другими словами способной нескончаемо плодиться и дифференцироваться во все типы клеток, составляющих взрослый организм – как эмбриональная стволовая клеточка.
К огорчению, эти клеточки iPSC в итоге бессчетных шагов, нужных для их перепрограммирования, теряют некие из собственных специфичных функций, приобретаемых с годами. Они нередко напоминают быстрее фетальные клеточки, чем зрелые клеточки взрослого человека. Не так давно группа исследователей из Института Бабрахама в Камдбридже разработала способ перепрограммирования клеток, позволяющий сделать их на биологическом уровне наиболее юными, но при всем этом способными восстанавливать свои спец клеточные функции. Исследование было размещено в журнальчике eLife.
С целью сохранить индивидуальности клеток, сделав их наиболее юными, исследователи опираются на работу Синья Яманака, который в 2007 году стал первым ученым, продемонстрировавшим способность превращать обычные клеточки в стволовые. Этот процесс занимает около 50 дней с внедрением 4 главных молекул, узнаваемых как “причины Яманаки”. Это техническое достижение принесло ему Нобелевскую премию по физиологии и медицине 2012 года. Не считая того, крайние работы проявили, что эпигеном – набор конфигураций в клеточке, которые изменяют экспрессию генов без конфигурации главный последовательности ДНК – омолаживается уже на первом шаге перепрограммирования (фаза созревания). Это гласит о том, что полное перепрограммирование iPSC не является нужным для того, чтоб направить назад старение соматических клеток.
Потому исследователи употребляли донорские дермальные фибробласты среднего возраста, чтоб узнать, когда необходимо приостановить процесс перепрограммирования. Поначалу они подвергли их действию причин Яманаки и нашли, что клеточки временно утратили, а потом вновь обрели свою идентичность фибробластов всего через 13 дней. Это быть может соединено с эпигенетической памятью на уровне активаторов и/либо неизменной экспрессией определенных генов фибробластов. Этот новейший способ именуется “переходное перепрограммирование фазы созревания”.
Является ли старение вопросцем хронологического либо био возраста?
Доктор Дильжит Гилл, постдокторант лаборатории Вольфа Рейка в Институте (который делал работу в качестве аспиранта), разъясняет в пресс-релизе: “Наше осознание старения на молекулярном уровне продвинулось за крайнее десятилетие, что привело к возникновению способов, позволяющих исследователям определять возрастные био конфигурации в клеточках человека. Мы смогли применить это в нашем опыте, чтоб найти степень перепрограммирования в нашем новеньком способе”.
Чтоб проверить, был ли процесс регенерации удачным, они изучили так именуемые эпигенетические часы и транскриптомы. Крайняя соответствует всем молекулам информационной РНК клеточки, репликам генов, находящихся в клеточке в активном состоянии. Со собственной стороны, эпигенетические часы — это математическая модель, которая предвещает возраст методом измерения уровней метилирования ДНК в разных участках генома.
Необходимо подчеркнуть, что метилирование ДНК – это процесс, при котором к молекуле ДНК добавляются метильные группы, что может поменять функцию гена без конфигурации главный последовательности ДНК. Такое метилирование ДНК нужно для здорового роста и развития клеток, и на него влияют стиль жизни и причины окружающей среды. Потому эпигенетические часы могут быть применены для оценки био возраста ткани, типа клеток либо органа методом сопоставления “возраста метилирования ДНК” (либо био возраста) с хронологическим возрастом в разных тканях. По обоим показателям перепрограммированные клеточки соответствовали профилю клеток, которые были на 30 лет молодее, чем эталонные наборы данных.
Последствия для регенеративной медицины
Потом анализ показал, что клеточки вернули маркеры, соответствующие для клеток кожи, в том числе наблюдалась выработка коллагена в перепрограммированных клеточках. Фибробласты создают коллаген. Эта молекула находится в костях, сухожилиях и связках кожи, помогает структурировать ткани и заживлять раны. Исследователи нашли, что омоложенные фибробласты производили больше коллагена, чем контрольные клеточки (которые не подвергались процессу перепрограммирования).
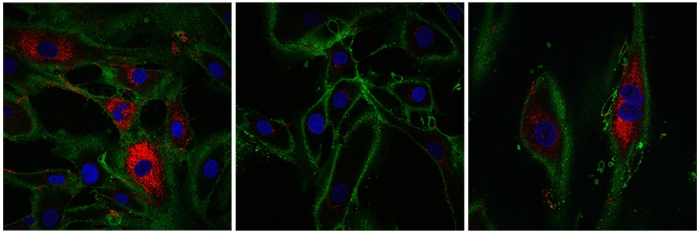
Слева – фибробласты человека в возрасте 20-22 лет. Посреди – состаренные фибробласты, не подвергавшиеся перепрограммированию. Справа – перепрограммированные клеточки. Коллаген показан красноватым цветом.
Не считая того, in vivo фибробласты передвигаются в области, которые нуждаются в восстановлении. Потом исследователи проверили эту способность на отчасти омоложенных клеточках. Для этого они срезают слой клеток, подобно разрезу на коже. Они нашли, что обработанные ими фибробласты резвее передвигались в пространстве, чем старенькые клеточки. Исследователи отмечают, что это перспективный символ для будущей способности сотворения клеток, способных лучше заживлять раны.
В конце концов, упомянутый выше анализ транскриптома показал признаки омоложения 2-ух определенных генов, вовлеченных в возрастные заболевания и симптомы: гена APBA2, связанного с заболеванием Альцгеймера, и гена MAF, который играет роль в развитии катаракты. Доктор Вольф Рейк, возглавлявший исследование, произнес: “Эта работа имеет весьма достойные внимания последствия. В итоге мы сможем найти гены, которые омолаживают организм без перепрограммирования, и специально нацелить их на те, которые уменьшают последствия старения”.
Вправду, хотя механизм переходного перепрограммирования еще не до конца понятен, ученые считают, что главные участки генома, участвующие в формировании идентичности клеток, могут избежать процесса перепрограммирования. Гилл заключает: “Наши результаты представляют собой большенный шаг вперед в нашем осознании клеточного перепрограммирования. Мы проявили, что клеточки могут быть омоложены без утраты их функций, и что омоложение ориентировано на восстановление неких функций старенькых клеток. Тот факт, что мы также следили оборотное изменение характеристик старения в генах, ассоциированных с болезнями, является в особенности перспективным для грядущего данной для нас работы”.
Источник
Читайте далее: